हेलो दोस्तों, क्या आप जानना चाहते है कि आवर्त सारणी क्या है? (Periodic table in hindi) यदि हाँ तो आप बिलकुल सही पोस्ट पर आये है क्योकि आज हम इस पोस्ट में आवर्त सारणी के बारे में विस्तार से पढ़ेंगे और समझेंगे, बस आपको इसे पूरा स्टेप बाई स्टेप पढ़ना होगा तो चलिए बिना समय बर्बाद किये शुरू करते है?
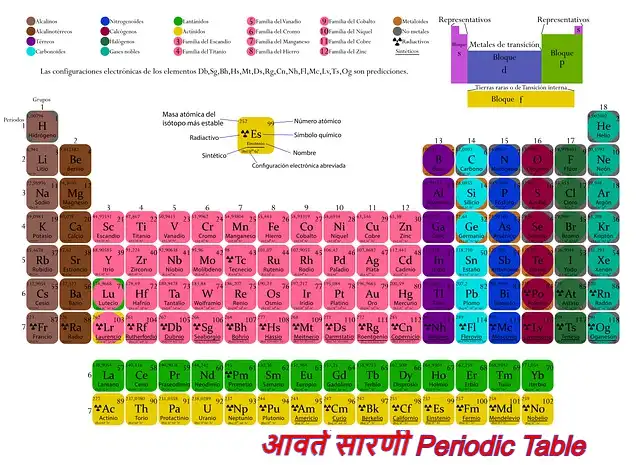
आवर्त सारणी क्या है? (What is Periodic Table in Hindi)
आवर्त सारणी (Periodic Table) –
तत्वों का क्रमबद्ध और सुव्यवस्थित अध्ययन करने के लिए वर्गीकरण करना आवश्यक समझा गया। वर्गीकरण का अभिप्राय है जिन तत्वों का रासायनिक गुणधर्म समान होता है। उसे एक ही समूह में रखा जाना चाहिए।
अब 118 तत्वों की खोज हो चुकी है। जिसमे से 92 तत्व प्रकृति में मुक्त अवस्था में पाए जाते है और शेष तत्वों को बैज्ञानिको ने कृत्रिम विधियों द्वारा तैयार किया है।
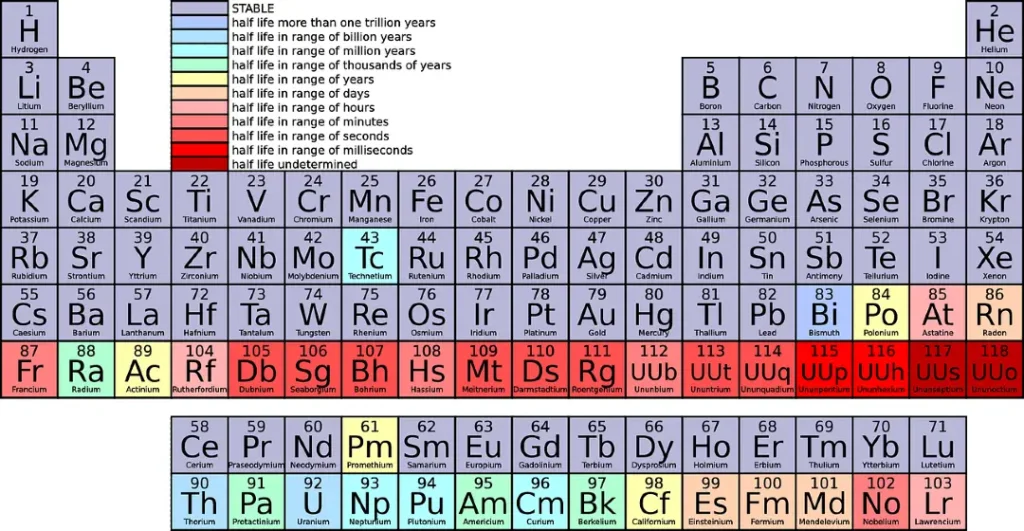
आवर्त सारणी की प्रगति (Development of Periodic Table) –
आवर्त सारणी की प्रगति के विषय में निम्नलिखित बैज्ञानिको ने अपना मत प्रस्तुत किया –
बर्जीलियस (Berzilius) –
बर्जीलियस नामक बैज्ञानिक ने सर्वप्रथम तत्वों के गुणधर्मो के आधार पर तत्वों को धातुओ तथा अधातुओं में वर्गीकृत किया। लेकिन यह वर्गीकरण अधिक उपयोगी सिद्ध नही हुआ इसके निम्नलिखित कारण है।
ग्रेफाइट तथा आयोडीन दोनों अधातु होते है परन्तु फिर भी इनमे धात्विक चमक पायी जाती है। मर्करी साधारण ताप पर द्रव है परन्तु इसे भी धातु वर्ग में रखा गया है। ग्रेफाइट तथा हाइड्रोजन अधातु होते हुए भी विधुत के सुचालक होते है।
प्राउस्ट की परिकल्पना (Proust’s Hypothesis) –
प्राउस्ट अनुसार प्रत्येक हाइड्रोजन परमाणुओं से मिलकर बना होता है। इसलिए वे एक दूसरे से परमाणु द्रव्यमान द्वारा सम्बंधित रहते है। तत्व का परमाणु द्रव्यमान रासायनिक अभिक्रिया के उपरांत भी अपरिवर्तित रहता है। यही कारण है कि इन्होने परमाणु द्रव्यमान को तत्वों का मौलिक गुणधर्म निर्धारित किया।
डोबेराइनर का त्रिक (Dobereiner’s Triads) –
इन्होने सामान्य गुणधर्म वाले तत्वों को उसके परमाणु द्रव्यमानो के बढ़ते हुए क्रम में व्यवस्थित किया और बताया कि बीच वाले तत्व का परमाणु द्रव्यमान पहले और तीसरे तत्व के परमाणु द्रव्यमानो के समान्तर माध्य के बराबर होता है।
उदाहरण –
| तत्त्व | Li | Na | K |
| परमाणु द्रव्यमान | 7 | 23 | 39 |
| सामान्तर माध्य = 7+39/2 = 23 |
ड्यूमा की सजातीय श्रेणी (Duma’s Homologous Series) –
तत्वों के परमाणु द्रव्यमान में सजातीय श्रेणी के मान सम्बन्ध है यही ड्यूमा की सजातीय श्रेणी है।
N = 14 = a
P = 31 = 14+17 = a+b
As = 75 = 14+17+44 = a+b+c
sb = 199 = 14+17+75+2*44 = a+b+2c
Bi = 207 = 14+17+4*44 = a+b+4c
- इन्हें भी पढ़े –
- वर्गिकी, वर्गीकरण, नामकरण किसे कहते है? पूरी जानकारी एकदम सरल भाषा में।
- कशेरुकी और अकशेरुकी में क्या अंतर है? पूरी जानकारी ।
- कोशिका किसे कहते है | खोज, प्रकार, संरचना, कार्य पूरी जानकारी।
- जीवाश्म किसे कहते है | परिभाषा, प्रकार, कम्पलीट इनफार्मेशन जरूर पढ़े।
- लैंगिक प्रजनन क्या होता है, पूरी जानकारी
न्यूलैंड का अष्टक नियम (Newland’s Octaves Law) –
न्यूलैंड नामक बैज्ञानिक ने तत्वों का वर्गीकरण संगीत के आधार पर किया था। यह आवर्त सारणी का प्रथम प्रस्ताव है इन्होने तत्वों के परमाणु द्रव्यमानो को बढ़ते हुए क्रम में व्यवस्थित किया। जिससे इन्होने देखा कि पहला तत्व आठवे तत्व से गुणों में समानता प्रदर्शित करता है।
| सा | रे | गा | मा | पा | धा | नी |
| LI | Be | B | C | N | O | F |
| Na | Mg | Al | Si | P | S | Cl |
| K | Ca | Ga | Ge | As | Se | Br |
| Rb | Sr | In | Sn | Sb | Te | I |
| Cs | Ba | Tl | Pb | Bi | Po | At |
| Fr | Ra |
लोथर मेयर का वक्र (Lother Mayer’s Curves) –
मेंडलीफ आवर्त सारणी की विशेषताए (Properties of Mendleff Periodic Table) –
मेंडलीफ के आवर्त सारणी की प्रमुख विशेषताए निम्नलिखित है।
तत्वों के अध्ययन में सुविधा –
मेंडलीफ के समय ज्ञात 63 तत्वों को 9 वर्गो में विभाजित किया गया। जिससे नव तत्वों का अध्ययन कर लेने से शेष सभी तत्वों के विषय में कुछ न कुछ जानकारी प्राप्त हो जाती है। जिससे तत्वों के अध्ययन में सुविधा प्राप्त हुई।
नई तत्वों की खोज में –
मेंडलीफ ने अपनी मूल आवर्त सारणी में कुछ रिक्त स्थान छोड़ दिए थे। तथा कुछ नए तत्वों के नाम एवं उनके गुणों की भविष्यवाणी की थी। जिससे नए तत्वों की खोज में सुविधा प्राप्त हुई।
त्रुटी पूर्ण परमाणु भार के संसोधन में –
मेंडलीफ को आवर्त सारणी द्वारा कुछ तत्वों के परमाणु भारो में संसोधन किया गया जैसे 1869 के पूर्ण Be (बेरेलियम) का परमाणु भार 13.5 माना जाता है परन्तु मेंडलीफ की आवर्त सारणी के अनुसार Be का परमाणु भार 9.4 निर्धारित हुआ।
मेंडलीफ के आवर्त सारणी के दोष –
मेंडलीफ के आवर्त सारणी में प्रमुख दोष निम्नलिखित है।
- आवर्त सारणी में हाइड्रोजन का स्थान अनिश्चित है। हाइड्रोजन के गुण धर्म IA (First A) वर्ग से मिलते जुलते है। इसलिए इसे IA वर्ग में रखा गया है जबकि इसके गुण धर्म हैलोजन से मिलते जुलते है इसीलिए हाइड्रोजन को VII A वर्ग में भी रखा गया है।
- मेंडलीफ की आवर्त सारणी में कोबाल्ट तथा निकिल का परमाणु द्रव्यमान 59 मानकर आवर्त सारणी में व्यवस्थित किया था। लेकिन प्रयोगों द्वारा सत्यापित हुआ कि कोबाल्ट का परमाणु द्रव्यमान 58.93 तथा निकिल का परमाणु द्रव्यमान 58.71 पाया गया। जो कि परमाणु द्रव्यमान के घटते हुए क्रम को प्रदर्शित करता है। जबकि मेंडलीफ की आवर्त सारणी परमाणु द्रव्यमान के बढ़ते हुए क्रम में बनायीं गई है।
- उत्कृष्ट गैसे लैंथेनाईट तथा एक्टेनाईट तत्वों को आवर्त सारणी में उचित स्थान नहीं दिया गया है।
- समस्थानिक तथा सम्भारिक तत्वों की खोज के पश्चात यह स्पस्ट हुआ कि तत्वों का मौलिक गुण धर्म परमाणु क्रमांक है न कि परमाणु द्रव्यमान।
आधुनिक आवर्त सारणी क्या है? (What is Modern Periodic table Law?)
आधुनिक आवर्त नियम (Modern Period Law) –
रेडियोएक्टिवता समस्थानिक तथा सम्भारिक आदि के खोज के पश्चात मोजले नामक बैज्ञानिक ने यह सिद्ध किया कि तत्वों का मौलिक गुण परमाणु क्रमांक है। न कि परमाणु द्रव्यमान इस प्रकार के नियम को आधुनिक आवर्त नियम कहा जाता है।
आधुनिक आवर्त नियम के अनुसार तत्वों के भौतिक गुण एवं रासायनिक गुण उनके परमाणु क्रमांको के आवर्ती फलन होते है। इसे मेंडलीफ की आधुनिक आवर्त सारणी भी कहा जाता है।
मेंडलीफ आधुनिक आवर्त सारणी (Mendeleff’s Modern Periodic Table) –
मेंडलीफ नामक बैज्ञानिक ने 1963 में तत्वों को उनके परमाणु क्रमांको के बढ़ते हुए क्रम में व्यवस्थित किया। जिसके फलस्वरूप एक नई सारणी का निर्माण होता है। जिसे मेंडलीफ का आधुनिक आवर्त सारणी कहा जाता है।
मेंडलीफ की आधुनिक आवर्त सारणी की विशेषताए निम्नलिखित है।
मेंडलीफ के आवर्त सारणी को क्षैतिज पंक्तियों तथा ऊर्ध्वाधर स्तंभों में विभाजित किया गया है। इन क्षैतिज पंक्तियों को आवर्त कहा जाता है। तथा ऊर्ध्वाधर स्तंभों को वर्ग अथवा समूह कहा जाता है।
आवर्त (Period) –
मेंडलीफ की आधुनिक आवर्त सारणी में कुल सात आवर्त बनाये गये है। ये आवर्त 10 क्षैतिज पंक्तियों से बने है जिन्हें श्रेणिया कहा जाता है।
पहला, दूसरा, तीसरा तथा सातवाँ आवर्त एक एक क्षैतिज पंक्तियों से बना है तथा चौथा, पांचवा, छठवां आवर्त दो – दो क्षैतिज पंक्तियों से बना है।
चौथे, पांचवे तथा छठवें आवर्त के दो – दो क्षैतिज पंक्तियों को क्रमशः समश्रेणी तथा विषम श्रेणी कहा जाता है।
प्रथम आवर्त को अति लघु आवर्त कहा जाता है जिसमे 2 तत्व रखे गये है।
दूसरे तथा तीसरे आवर्त को लघु आवर्त कहा जाता है जिसमे 8 – 8 तत्वों को रखा गया है।
चौथे तथा पांचवे आवर्त को दीर्घ आवर्त कहा जाता है। जिसमे 18 – 18 तत्व रखे गये है छठे आवर्त को अति दीर्घ आवर्त कहा जाता है। जिसमे कुल 32 तत्व रखे गए है। इनमे से 14 तत्वों को आवर्त सारणी से बाहर (परमाणु क्रमांक 58 से लेकर 71 तक) एक श्रेणी में रखा गया है। जिसे लैंथेनाईट श्रेणी कहा जाता है।
सातवे आवर्त को अतिदीर्घ आवर्त कहा जाता है जिसमे 28 तत्व रखे गए है। इनमे से 14 तत्व (परमाणु क्रमांक 90 से 103 तक) आवर्त सारणी से बाहर एक श्रेणी में रखा गया है। जिसे एक्टीनाइट श्रेणी कहा जाता है।
समूह या वर्ग (Group) –
मेंडलीफ की आधुनिक आवर्त सारणी में कुल वर्गो की संख्या है जिसे क्रमशः I, II, III, IV, V, VI, VII तथा VIII एवं शून्य वर्ग बनाया गया है। शून्य तथा आठवे वर्ग को छोड़कर शेष सभी वर्गो की दो उपवर्गों में विभाजित किया गया है। जिसे उपवर्ग A तथा उपवर्ग B कहा जाता है।
NEET या दूसरे बोर्ड Exams के लिए कम्पलीट नोट्स बुक –
NEET Teachers के द्वारा एकदम सरल भाषा में लिखी गई नोट्स बुक 3 in 1, यानि कि एक ही किताब में जीव विज्ञान, रसायन विज्ञान और भौतिक विज्ञान की कम्पलीट कोर्स। यदि आपको इसकी जरूरत है तो नीचे दिए गये बुक इमेज पर क्लिक कीजिये और इसके बारे में और भी जानिए।
प्रारूपी तत्व अथवा प्रतिरूपी तत्व अथवा निरूपक तत्व (Typical Element) –
मेंडलीफ के आधुनिक आवर्त सारणी में द्वितीय आवर्त तथा तृतीय आवर्त के तत्वों को ही निरूपक तत्व कहा जाता है। ये तत्व अपने ही वर्गो में उपस्थित अन्य तत्वों का आदर्श प्रतिनिधित्व करते है।
| I-A | II-A | III-A | IV-A | V-A | VI-A | VII-A | |
| आवर्त II – | Li | Be | B | C | N | O | F |
| आवर्त III – | Na | Mg | Al | Si | P | S | Cl |
जैसे – Li तथा Na प्रथम IA वर्ग के प्रारूपी तत्व है इसी प्रकार Be तथा Mg IIA वर्ग के निरूपक तत्व है। इसी प्रकार अन्य एक – दूसरे के निरूपक है।
विकर्णी सम्बन्ध (Diagonal relation) –
द्वितीय आवर्त के तत्व तृतीय आवर्त के उन तत्वों से गुणों में समानता प्रदर्शित करते है जो कि एक दूसरे से विकर्ण अभिमुख होते है।
जैसे – II आवर्त का लीथियम III आवर्त के मैग्नीशियम से गुणों में समानता प्रदर्शित करता है।
| I-A | II-A | III-A | IV-A | V-A | VI-A | VII-A | |
| आवर्त II – | Li | Be | B | C | N | O | F |
| आवर्त III – | Na | Mg | Al | Si | P | S | Cl |
Li तथा Mg के गुणों में समानता –
Li तथा Mg एक दूसरे से विकर्णी सम्बन्ध प्रदर्शित करते है जिनके समान गुण निम् प्रकार के है।
लीथियम नाइट्रेट (LiNO3) तथा मैग्नीशियम नाइट्रेट दोनों को गर्म करने पर दोनों ही ऑक्सीजन गैस उत्पन्न करते है।
जैसे – 2LiNO3 ………………. Li2O + 2NO2 + 1/2O2
Mg(NO3)2 ………………….. MgO + 2NO2 + 1/2O2
लीथियम कार्बोनेट (Li2CO3) तथा मैग्नीशियम कार्बोनेट (MgCO3) को गर्म करने पर कार्बन डाई ऑक्साइड गैस बनाती है।
Li2CO3 ……………… Li2O + CO2
MgCO3 ……………….. MgO + CO2
लीथियम हाइड्राक्साइड (LiOH) तथा मैग्नीशियम Mg(OH)2 को गर्म करने पर जल बनता है।
2LiOH ——————– Li2O + H2O
Mg(OH)2 —————- MgO + H2O
लीथियम तथा मैग्नीशियम दोनों ही नाइट्रोजन से सीधे संयोग करके नाइट्राइड बनाते है।
6Li + N2 ————– 2Li3N
3Mg + N2 ————— Mg3N2
सेतु तत्व (Bridge Element) –
तृतीय आवर्त के I वर्ग से लेकर III वर्ग के तत्व सेतु तत्व कहलाते है। ये तत्व अपने वर्ग के तत्वों के उपवर्गों के तत्वों के मध्य सेतु का कार्य करते है ये तत्व गुणों में दोनों उपवर्गों के तत्वों से समानता रखता है।
सामान्य तत्व (Normal Element) –
वे तत्व जिनके गुणधर्म सेतु तत्व से अधिक समानता रखते है। तो ऐसे तत्व सामान्य तत्व कहलाते है। मेंडलीफ के आधुनिक आवर्त सारणी में सभी उपवर्ग – A वाले तत्व सामान्य तत्व कहलाते है।
संक्रमण तत्व (Transition Element) –
वे तत्व जिनके गुण धर्म सेतु तत्वों से कम समानता रखते है। तो ऐसे तत्वों को संक्रमण तत्व कहलाते है। मेंडलीफ की आधुनिक आवर्त सारणी में सभी उपवर्ग – B वाले तत्व संक्रमण तत्व कहलाते है। सातवे वर्ग को भी संक्रमण तत्व में रखा गया है।
आंतरिक संक्रमण तत्व (Inner Transition Element) –
परमाणु क्रमांक 57 – 71 तक के तत्व आवर्त सारणी से बाहर एक श्रेणी में रखा गया है। जिसे लैंथेनाईट श्रेणी कहा जाता है। इस श्रेणी के तत्व गुणों में समानता रखते है। लैंथेनाईट श्रेणी में पाये जाने वाले तत्व को दुर्लभ मृदा धातु कहा जाता है।
इसी प्रकार परमाणु क्रमांक 90 से 103 तक के तत्व एक्टिनाइट श्रेणी के तत्व कहलाते है। इसी श्रेणी के तत्व गुणों में समानता रखते है।
लैंथेनाईट श्रेणी के तत्व तथा एक्टिनाइट श्रेणी के तत्व सामूहिक रूप से आंतरिक संक्रमण तत्व कहलाते है।
दीर्घाकार अथवा प्रावर्धित आवर्त सारणी (Longterm Or Extended form of Perodic Table) –
मोजले के आधुनिक आवर्त सारणी के पश्चात बोर नामक बैज्ञानिक ने तत्वों का इलेक्ट्रानिक विन्यास एवं उनके भौतिक गुण तथा रासायनिक गुण में घनिष्ट सम्बन्ध स्थापित किया। इन्होने बताया कि जिन तत्वों के बाह्य कोश का इलेक्ट्रानिक विन्यास एक समान होता है। उन तत्वों के गुणों में समानता पायी जाती है।
Rang Warner तथा Bury नामक बैज्ञानिक ने तत्वों के इलेक्ट्रानिक विन्यास को आधार मानकर एक नई आवर्त सारणी का निर्माण किया। जिसे दीर्घाकार अथवा प्रावर्धित आवर्त सारणी कहा जाता है। इसे बोर की आवर्त सारणी भी कहते है क्योकि यह बोर के इलेक्ट्रानिक विन्यास पर आधारित होता है।
“ वास्तव में दीर्घाकार आवर्त सारणी मेंडलीफ की आवर्त सारणी का परिवर्तित रूप है। ”
समूह या वर्ग (Group) –
दीर्घाकार आवर्त सारणी में कुल वर्गो की संख्या 9 है। शून्य समूह तथा आठवें समूह को छोड़कर शेष सभी वर्गों को दो उपवर्गों में विभाजित किया गया है।
- I-A उपवर्ग से लेकर VII-A उपवर्ग के तत्व प्रसामान्य तत्व कहलाते है।
- I-B उपवर्ग से लेकर VII-B उपवर्ग के तत्व तथा आठवें वर्ग का तत्व संक्रमण तत्व कहलाते है।
अक्रिय गैसों को अथवा उत्कृष्ट गैसों को शून्य वर्ग में रखा गया है।
आवर्त (Period) –
दीर्घाकार आवर्त सारणी में मेंडलीफ के समान 7 आवर्त बनाये गए है।
परम लघु आवर्त –
प्रथम आवर्त को परम लघु आवर्त कहा जाता है इसमे दो तत्व H तथा He रखे गए है।
लघु आवर्त –
दूसरे तथा तीसरे आवर्त को लघु आवर्त कहा जाता है इसमें आठ – आठ तत्व रखे गये है।
दीर्घ आवर्त –
चौथे तथा पांचवे आवर्त को दीर्घ आवर्त कहा जाता है जिसमे 18 – 18 तत्वों को रखा एक ही खाने में रखा गया है।
अतिदीर्घ आवर्त –
छठवे आवर्त को अतिदीर्घ आवर्त कहा जाता है। इसमें कुल 32 तत्व रखे गये है। इन तत्वों में से 14 तत्व आवर्त सारणी से बाहर एक श्रेणी में रखा गया है। जिसे लैंथेनाइड श्रेणी कहा जाता है।
Lanthenoids Series = 58 – 71
अतिदीर्घ आवर्त –
सातवें आवर्त को भी अतिदीर्घ आवर्त कहा जाता है यह आवर्त अपूर्ण आवर्त है। इसमें कुल 28 तत्व है। इनमे से 14 तत्व एक श्रेणी में रखे गये है जिसे एक्टिनाइड श्रेणी कहते है। इस आवर्त के सभी तत्व रेडियोएक्टिव तत्व है।
Actinoids Series = 90 – 103
दीर्घाकार आवर्त सारणी की विशेषताए –
दीर्घाकार आवर्त सारणी की प्रमुख विशेषताए निम्नलिखित है।
- चूँकि दीर्घाकार आवर्त सारणी इलेक्ट्रानिक विन्यास के आधार पर बनायीं गयी है अतः इसे आसानी से याद किया जा सकता है।
- दीर्घाकार आवर्त सारणी को चार ब्लाको में विभाजित किया गया है जिसे क्रमशः s, p, d तथा f ब्लाक कहा जाता है।
- दीर्घाकार आवर्त सारणी में उपवर्ग A तथा उपवर्ग B की पूर्णतः अलग कर दिया गया जिससे एक ही असमान गुणों वाले तत्वों का दोष स्वतः समाप्त हो गया।
- d ब्लाक के तत्वों को संक्रमण तत्व कहा जाता है संक्रमण तत्वों को s ब्लाक तथा p ब्लाक के मध्य रखा गया है।
- दीर्घाकार आवर्त सारणी में अक्रिय गैसों की आवर्त सारणी के दाहिनी ओर शून्य वर्ग में रखा गया है।
- लैन्थेनाइड तथा एक्टिनाइड तत्वों को आवर्त सारणी के बाहर दो श्रेणियों में रखा गया है। जो कि आवर्त सारणी के नीचे है।
4f Series = Lanthenoids Series = 58 – 71
5f Series = Actinoids Series = 90 – 103
S – ब्लाक तत्व (S – Block Element) –
जिन तत्वों का विभेदी इलेक्ट्रान अंतिम कक्षा के s ऑर्बिटल में प्रवेश करता है। ऐसे तत्वों को s ब्लाक के तत्व कहा जाता है।
आवर्त सारणी के I-A उपवर्ग तथा II-A उपवर्ग के तत्वों को s ब्लाक का तत्व कहा जाता है।
I-A उपवर्ग के तत्वों को क्षार धातुये कहा जाता है। जबकि II-A उपवर्ग के तत्वों को क्षारीय मृदा धातु कहा जाता है।
S – ब्लाक के तत्वों को सामूहिक रूप से प्रसामान्य तत्व कहा जाता है।
क्षार धातुओ के s कक्षक में 1 इलेक्ट्रान होते है जबकि क्षारीय मृदा धातुओ में के s कक्षक में 2 इलेक्ट्रान होते है। H तथा He तत्वों को भी s ब्लाक में रखा गया है।
S ब्लाक के तत्वों की प्रमुख विशेषताए निम्नलिखित है।
- S ब्लाक के तत्वों की एक निश्चित संयोजकता है जैसे – क्षार धातुओ Na तथा K की संयोजकता 1 होती है। जबकि क्षारीय मृदा धातु जैसे Ca तथा Be की संयोजकता 2 होती है।
- H तथा He को छोड़कर s ब्लाक के तत्व सभी धातु है।
- s ब्लाक के तत्व भास्मिक होते है।
- s ब्लाक के तत्व जटिल ऋणायन नही बनाते है।
- s ब्लाक के तत्वों का आयनन विभव कम नहीं होता है। यही कारण है कि ये प्रबल धनायन बनाते है।
- जैसे – Ca+2, Ba+2 etc.
- S ब्लाक के तत्व बैद्दुत संयोजी यौगिक बनाते है।
- S ब्लाक के तत्वों का मानक इलेक्ट्रोड विभव ऋणात्मक होता है। यही कारण है कि s ब्लाक के तत्व क्रियाशील होते है।
P ब्लाक तत्व किसे कहते है? (What is p Block Element)
p ब्लाक तत्व –
जिन तत्वों का विभेदी इलेक्ट्रान अंतिम कोश के p ऑर्बिटल में प्रवेश करता है। तो ऐसे ही तत्वों को p ब्लाक का तत्व कहा जाता है।
मेंडलीफ की मूल आवर्त सारणी में III-A, IV-A, V-A, VI-A, VII-A तथा शून्य वर्ग के तत्वों में अंतिम इलेक्ट्रान p उपकोश में प्रवेश करता है। अतः ये सभी वर्ग p ब्लाक के तत्व है शून्य वर्ग में p कक्षक पूर्ण रूप से भरे होते है। p ब्लाक के तत्वों को सामूहिक रूप से सामान्य तत्व कहा जाता है। इन तत्वों का इलेक्ट्रानिक विन्यास ns2, np1 से लेकर ns2, np6 तक होता है।
P ब्लाक के तत्वों की प्रमुख विशेषताए निम्नलिखित है।
- P ब्लाक के तत्व निश्चित संयोजकता रखते है। कुछ तत्व परिवर्तित संयोजकता भी दर्शाते है। जैसे – N, P इन तत्वों की संयोजकता 3 तथा 5 होता है।
- P ब्लाक के तत्व अधातु तथा उपधातु होते है। कुछ तत्व भारी धातु भी होते है। जैसे Pb तथा Bi
- p ब्लाक के तत्व जटिल ऋणायन बनाते है। जैसे – Co3-2, Po4-3, No3-, So4-2, ClO3-
- p ब्लाक के तत्व आपस में सह्संयोजी बंध बनाते है। परन्तु s ब्लाक के तत्वों के साथ बैद्दुत संयोजी बंध बनाते है।
- p ब्लाक के तत्व ऑक्सी अम्ल बनाते है। जैसे – H2SO4
d ब्लाक के तत्व किसे कहते है? (What is d block Element)
d ब्लाक के तत्व –
जिन तत्वों का विभेदी इलेक्ट्रान अंतिम कोश के पहले कोश के d ऑर्बिटल लमे प्रवेश करता है। तो ऐसे तत्वों को d ब्लाक के तत्व कहा जाता है। इस तत्व के अंतिम दो बाह्य कोश अपूर्ण होते है। d ब्लाक के तत्वों को सामूहिक रूप से संक्रमण तत्व कहा जाता है।
मेंडलीफ के आवर्त सारणी में I-B से VII-B तथा आठवे वर्ग को संक्रमण तत्व कहा जाता है। संक्रमण तत्वों को इलेक्ट्रानिक विन्यास (n-1) ns2 nd1 से (n-1) ns2d10 तक होता है।
अपवाद – 29 Cu = [Ar], 4s1, 3d10
30 Zn = [Ar], 4s2, 3d10
अपवाद – 47 Ag = [Kr], 5s1, 4d10
48 Cd = [Kr], 5s2, 4d10
अपवाद – 79 Au = [Xe], 6s1, 4f14, 5d10
कापर तथा जिंक, सिल्वर, कैडमियम एवं गोल्ड तथा मर्करी इसमें क्रमशः 3d, 4d, 5d में 10 – 10 इलेक्ट्रान पूर्ण भरे होते है।
इलेक्ट्रानिक विन्यास के आधार पर इन तत्वों को सामान्य तत्वों के साथ रखा जाना चाहिए था। परन्तु इन्हें संक्रमण तत्वों के साथ d ब्लाक में रखा गया है। क्योकि इनके गुणधर्म संक्रमण तत्वों से मिलते जुलते है।
संक्रमण तत्वों की प्रमुख विशेषताए निम्नलिखित है।
- d ब्लाक के तत्व परिवर्तित संयोजकता दर्शाते है।
- d ब्लाक के त्तत्व सभी धातु है मर्करी को छोड़कर सभी धातुये ठोस है।
- d ब्लाक के तत्व रंगीन आयन तथा संकर यौगिक बनाते है।
- d ब्लाक के तत्व उत्प्रेरक के रूप में प्रयुक्त होते है।
- d ब्लाक के तत्व अधिकांश रूप से अयुग्मित इलेक्ट्रान रखते है। जिसके कारण ये अचुम्बकीय व्यवहार प्रदर्शित करते है। यह गुण कोबाल्ट (Co) निकिल (Ni) तथा आयरन (Fe) में अधिकतम पायी जाती है।
f ब्लाक तत्व किसे कहते है? (What is f block Element)
f ब्लाक के तत्व –
जिन तत्वों का विभेदी इलेक्ट्रान (n-2) f उपकोश में प्रवेश करता है। तो ऐसे ही तत्वों को f ब्लाक के तत्व कहा जाता है। इस तत्व का बाह्य तीन कोश अपूर्ण होते है।
f ब्लाक के तत्वों को सामूहिक रूप से आंतरिक संक्रमण तत्व (Inner Transition Element) कहा जाता है।
f ब्लाक के तत्वों का इलेक्ट्रानिक विन्यास (n-2) s2p6d10f14 होता है। आंतरिक संक्रमण तत्वों को दो श्रेणियों में विभाजित किया गया है। जिसे लैन्थेनाइड तथा एक्टिनाइड श्रेणी कहा जाता है।
4f Series = Lanthenoids Series = 58 – 71
5f Series = Actinoids Series = 90 – 103
आंतरिक संक्रमण तत्वों का प्रमुख गुणधर्म निम्नलिखित है।
- आंतरिक संक्रमण तत्व परिवर्ती संयोजकता दर्शाते है।
- आंतरिक संक्रमण तत्व सभी धातु होते है। जिसे आंतरिक संक्रमण धातु कहा जाता है।
- आंतरिक संक्रमण तत्व भी अचुम्बकीय व्यवहार प्रदर्शित करते है।
- आन्तरिक संक्रमण तत्व संकर आयन बनाते है।
- f ब्लाक के तत्व बैद्दुत संयोजी यौगिक बनाने की क्षमता रखते है।
परमाणु त्रिज्या किसे कहते है? (What is Atomic Radius)
परमाणु त्रिज्या (Atomic Radius) –
किसी भी तत्व का परमाणु आकार परमाणु त्रिज्या या परमाणु आयन द्वारा व्यक्त किया जाता है। किसी भी तत्व के परमाणु की परमाणु त्रिज्या उसके बाह्यतम कोश के परमाणु नाभिक से दूरी को ही परमाणु त्रिज्या कहा जाता है।
किसी भी आयन की आयनिक त्रिज्या उस आयन की परमाणु नाभिक से बाह्यतम कोश के बीच की दूरी होती है।
आवर्त (Period) –
आवर्त सारणी के किसी भी आवर्त में बाये से दाए की तरफ चलने पर परमाणु क्रमांक बढ़ने के साथ – साथ परमाणु आकार का मान घटता जाता है।
जब आवर्त में बाए से दाए की तरफ चलने पर परमाणु क्रमांक बढ़ता है। साथ ही साथ नाभिक के आवेशो का मान भी बढ़ता जाता है। परन्तु कोशो की संख्या वही रहती है।
नाभिक आवेशो का मान बढ़ने के कारण इलेक्ट्रानो के प्रति नाभिक का आकर्षण बल बढ़ता जाता है। फलतः इलेक्ट्रान नाभिक की ओर खिच जाता है। जिससे परमाणु त्रिज्या कम हो जाती है। तथा परमाणु के आकार का मान परमाणु क्रमांक के बढ़ने के साथ – साथ घटता जाता है।
वर्ग या समूह (Group) –
आवर्त सारणी के किसी भी वर्ग में ऊपर से नीचे की तरफ जाने में परमाणु क्रमांक बढ़ने के साथ – साथ परमाणु आकार का मान बढ़ता है।
वर्गो में ऊपर से नीचे की ओर चलने पर इलेक्ट्रानो की संख्या में वृद्धि नाभिकीय आवेशो की तुलना में अधिक होता है। जिससे इलेक्ट्रानो की संख्या में वृद्धि का प्रभाव नाभिकीय आवेशो की संख्या में वृद्धि के प्रभाव तुलना में अधिक होता है। जिससे कोशो की संख्या बढ़ जाती है।
इलेक्ट्रानो की संख्या बढ़ने पर नाभिक के आकर्षण बल का मान कम हो जाता है। फलतः इलेक्ट्रानो का खिचाव कम हो जाता है। जिससे परमाणु आकार का मान बढ़ जाता है। अतः वर्गो में ऊपर से नीचे की तरफ जाने पर परमाणु क्रमांक बढ़ने के साथ – साथ परमाणु आकार भी बढ़ता है।
n = मुख्य क्वांटम संख्या अथवा कोशो की संख्या जैसे – जैसे n का मान बढ़ता जाता है। वैसे – वैसे परमाणु आकार का मान बढ़ता जाता है।
उदाहरण –
11 Na = 1s1, 2s2, 2p6, 3s1
n = 3
19 K = [Ar], 4s1
n = 4
चूँकि K के लिए n का मान अधिक अतः पोटैशियम का आकार सोडियम से बड़ा होगा।
Conclusion –
दोस्तों अब हम देख लेते है कि किन – किन चीजो के बारे में हम लोगो ने अध्ययन किया है।
- आवर्त सारणी (Periodic Table)
- बर्जीलियस (Berzilius)
- प्राउस्ट की परिकल्पना (Proust’s Hypothesis)
- डोबेराइनर का त्रिक (Dobereiner’s Triads)
- ड्यूमा की सजातीय श्रेणी (Duma’s Homologous Series)
- 5- न्यूलैंड का अष्टक नियम (Newland’s Octaves Law)
- लोथर मेयर का वक्र (Lother Mayer’s Curves)
- मेंडलीफ आवर्त सारणी की विशेषताए (Properties of Mendleff Periodic Table)
- तत्वों के अध्ययन में सुविधा।
- नई तत्वों की खोज में।
- त्रुटी पूर्ण परमाणु भार के संसोधन में।
- मेंडलीफ के आवर्त सारणी के दोष।
- आधुनिक आवर्त नियम (Modern Period Law)
- मेंडलीफ आधुनिक आवर्त सारणी (Mendeleff’s Modern Periodic Table)
- मेंडलीफ की आधुनिक आवर्त सारणी की विशेषताए।
- प्रारूपी तत्व अथवा प्रतिरूपी तत्व अथवा निरूपक तत्व (Typical Element)
- विकर्णी सम्बन्ध (Diagonal relation)
- Li तथा Mg के गुणों में समानता।
- सेतु तत्व (Bridge Element)
- सामान्य तत्व (Normal Element)
- संक्रमण तत्व (Transition Element)
- आंतरिक संक्रमण तत्व (Inner Transition Element)
- दीर्घाकार अथवा प्रावर्धित आवर्त सारणी (Longterm Or Extended form of Perodic Table)
- समूह या वर्ग (Group)
- आवर्त (Period)
- परम लघु आवर्त।
- लघु आवर्त।
- दीर्घ आवर्त।
- अतिदीर्घ आवर्त।
- दीर्घाकार आवर्त सारणी की विशेषताए।
- S – ब्लाक तत्व (S – Block Element)
- p ब्लाक तत्व।
- d ब्लाक के तत्व।
- f ब्लाक के तत्व।
- परमाणु त्रिज्या (Atomic Radius)
- आवर्त (Period)
- वर्ग या समूह (Group)
दोस्तों आशा करता हूँ कि आपको आवर्त सारणी के बारे में दी गई जानकारी पसंद आयी होगी। अगर आपको यह दी गई जानकारी पसंद आयी है। तो प्लीज इसे अधिक से अधिक शेयर कीजिये।
Thank you very much