क्या आप रासायनिक संयोजन के नियम के बारे में शुरू से पढ़ना चाहते हैं यदि हाँ तो यह लेख सिर्फ आप के लिए ही है क्योकि आज हम रसायन विज्ञान class 11th के पहले चैप्टर के हैडिंग रासायनिक संयोजन के नियम का बहुत ही सरल भाषा में अध्ययन करने वाले हैं, तो चलिए बिना समय बर्बाद किये शुरू करते हैं।
रासायनिक संयोजन के नियम (Laws of Chemical Combination in Hindi)
रासायनिक अभिक्रिया संपन्न होने के लिए जिन नियमों का पालन करती हैं उन्हें ही रासायनिक संयोजन का नियम कहते हैं। इसके नियम कौन-कौन से हैं।
- द्रव्यमान संरक्षण का नियम
- स्थिर अनुपात का नियम
- गुणित अनुपात का नियम
- गैलुसैक का नियम
- आवोगाद्रो का नियम
द्रव्यमान संरक्षण का नियम (Law of Conservation of Mass in hindi)
किसी अभिक्रिया में अभिकारको का कुल द्रव्यमान एवं उत्पादों का कुल द्रव्यमान बराबर रहता है, यानि कि द्रव्यमान में ना तो वृद्धि होती है और ना ही कमी होती है तो यह द्रव्यमान संरक्षण का नियम कहलाता है।
यह नियम सबसे पहले एंटोनी लेवाजियर ने दिया था और यह रसायन विज्ञान का जनक भी कहा जाता है।
उदाहरण
CH4 + 2O2 → CO2 + 2H2O
2H2 + O2 → 2H2O
स्थिर अनुपात का नियम (Law of Definite Proportions in Hindi)
परिभाषा – इस नियम के अनुसार किसी भी रासायनिक पदार्थ में तत्व हमेशा निश्चित द्रव्यमान अनुपात में उपस्थित होते हैं। इस नियम को वैज्ञानिक जोसेफ प्राउस्ट ने दिया था।
जैसे – जल को कहीं से भी लिया जाए झरना, झील, तालाब, नाले, नदी आदि उसका अनुपात 1:8 ही होता है।
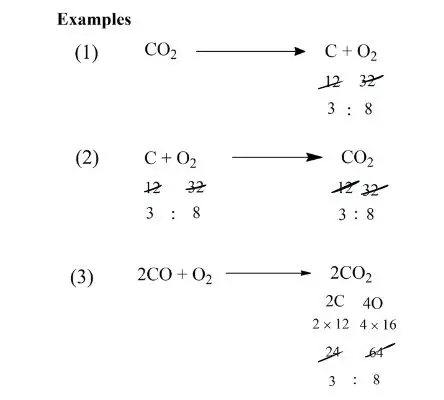
Q. 4 ग्राम हाइड्रोजन कुछ ऑक्सीजन के साथ प्रतिक्रिया करके 36 ग्राम पानी बनता है द्रव्यमान संरक्षण के नियम को लागू करके पता लगे की कितनी ऑक्सीजन का उपयोग किया गया होगा?
Ans.
हाइड्रोजन + ऑक्सीजन → जल
दिया गया द्रव्यमान :- हाइड्रोजन = 4 ग्राम, ऑक्सीजन = x ग्राम
पानी = 36 ग्राम
द्रव्यमान संरक्षण के नियमानुसार –
अभिकारको का द्रव्यमान = उत्पादों का द्रव्यमान
4 ग्राम + x ग्राम = 36 ग्राम
x ग्राम = 36 ग्राम – 4 ग्राम
x ग्राम = 34 ग्राम Answer
Q. यदि द्रव्यमान संरक्षण का नियम सत्य है तो कितना सोडियम क्लोराइड 34.0 ग्राम सिल्वर नाइट्रेट के साथ प्रतिक्रिया करके 17 ग्राम सोडियम नाइट्रेट और 28.70 ग्राम सिल्वर क्लोराइड उत्पन्न करेगा।

Q. किसी दिए गए यौगिक में हमेशा भार के अनुसार तत्वों का समान आयतन रहता है यह किस नियम के अनुसार सही है?
Ans स्थिर अनुपात का नियम
गुणित अनुपात का नियम (Law of Multiple Proportions in Hindi)
परिभाषा – यदि दो तत्व एक से अधिक यौगिक बनाने के लिए संयोजित हो सकते हैं तो एक तत्व का द्रव्यमान जो दूसरे तत्व के एक निश्चित द्रव्यमान के साथ संयोजित होता है छोटी पूर्ण संख्याओं सरल अनुपात में होते हैं।
इस नियम को जॉन डाल्टन ने दिया था।
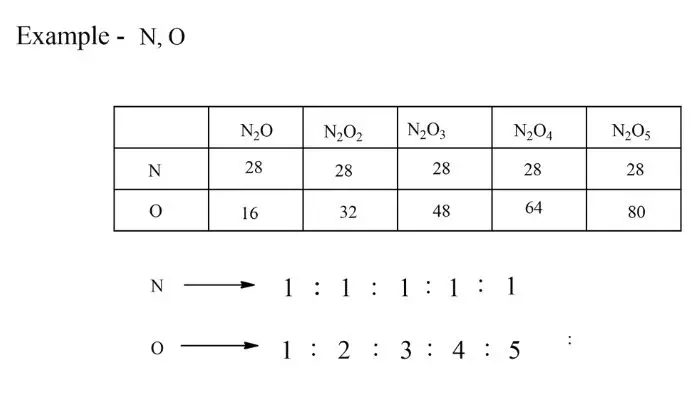
गैलु-सैक का नियम (Gay Lussac’s Law of Gaseous Volumes in Hindi)
जब रासायनिक अभिक्रियाओ में गैसे आपस में संयोग करती हैं तो उनके आयतन सरल अनुपात में होते हैं, बशर्ते सभी गैसें समान ताप और दाब पर हों
उदाहरण – एक आयतन अणु H2 एक आयतन अणु Cl2 के साथ संयोग करके 2 आयतन अखंडित गैस HCl निकलता है।
H2 + Cl2 → 2HCl
आयतन 1L + 1L = 2L
N2 + 3H2 → 2NH3
1:3:2
आवोगाद्रो का नियम (Avogadro’s Law in Hindi)
एक ही ताप और दाब पर सभी गैसों के समान आयतन में अणुओं की संख्या समान होती है प्रारंभ में इस संबंध को आवोगाद्रो की परिकल्पना कहा गया था लेकिन बाद में जब प्रयोगो द्वारा इसका परीक्षण किया गया तो इसे आवोगाद्रो का सिद्धांत कहा जाने लगा और अब इसे आवोगाद्रो का नियम कहते हैं।
महत्वपूर्ण बातें
- किसी भी गैस की एक ग्राम अणुभार में अणुओं की संख्या समान होती है इस संख्या को आवोगाद्रो संख्या कहते हैं।
- आवोगाद्रो की संख्या का मान विभिन्न विधियों से 6.022 ✕ 1023 प्राप्त होता है। इसे N से प्रदर्शित करते हैं।
- किसी पदार्थ की एक मूल में उपस्थित कणों (परमाणु अणु आयन) की संख्या 6.022 ✕ 1023 होती है इसे ही आवोगाद्रो संख्या कहते हैं।
उदाहरण 1- कार्बन C की द्रव्यमान संख्या या परमाणु भार 12 होता है अतः एक मोल कार्बन = 12 ग्राम कार्बन
अर्थात 12 ग्राम कार्बन में कार्बन परमाणु की संख्या 6.022 ✕ 1023 होगी।
उदाहरण 2 – जल का अणुभार 18 होता है।
अतः एक मोल जल = 18 ग्राम जल
अर्थात 18 ग्राम जल में जल के अणु की संख्या 6.022 ✕ 1023 होगी।
Q. 34 ग्राम NH3 में मौजूद परमाणुओं की कुल संख्या है?
1 mol NH3 = 17gm
17gm NH3 कणों की संख्या = 6.022 ✕ 1023
1gm NH3 में कणों की संख्या = 6.022 ✕ 1023/17
34 gm NH3 में कणों की संख्या = 6.022 ✕ 1023 ✕ 34/17 = 12.04 ✕ 1023
NH3 में 1 N परमाणु और 3 H परमाणु है यानि कुल 4 परमाणु है तो
34 gm में NH3 कुल परमाणुओं की संख्या = 4 ✕ 12.04 ✕ 1023 = 48.04 ✕ 1023 Ans.
Read next