नमस्कार दोस्तों, स्वागत है आपका हमारे इस वेबसाइट पर, दोस्तों आज इस आर्टिकल में हम द्रव्यमान संरक्षण का नियम क्या है? इसके बारे में पढ़ेंगे दोस्तों इसके साथ – साथ हम लोग और भी कुछ नियमों के बारे में बात करेंगे तो चलिए समय को बर्बाद न करते हुए शुरू करते है।
द्रव्यमान संरक्षण का नियम किसने दिया था?
सबसे पहले रूस के बैज्ञानिक M. V. Lomonosov ने सन 1756 ई० में द्रव्यमान संरक्षण के नियम को बताया। उसके बाद बैज्ञानिक लैंडोल्ट और लेवाशिए आदि बैज्ञानिको ने इसकी पुष्टि की।
द्रव्यमान संरक्षण का नियम क्या है?
द्रव्यमान संरक्षण का नियम या द्रव्य की अविनाशिता का नियम (Law of Conservation of Mass or Indestructibility of Matter) –
इस नियम के अनुसार –
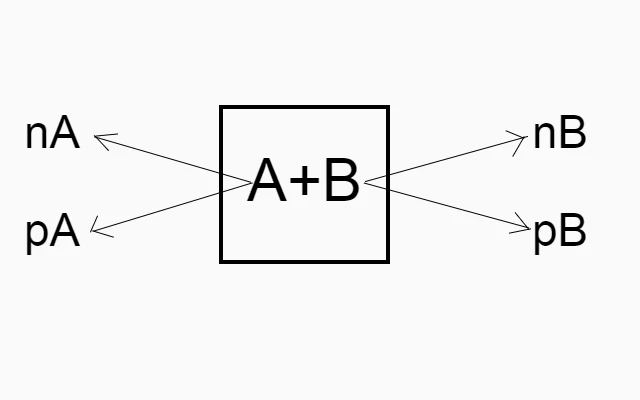
द्रव्य अविनाशी है मतलब द्रव्य को न तो उत्पन्न किया जा सकता है और न ही नष्ट किया जा सकता है इसे सिर्फ एक रूप से दूसरे रूप में बदला जा सकता है। इस प्रकार से किसी भी रासायनिक अभिक्रिया में परिवर्तन के बाद भी द्रब्य का कुल द्रव्यमान बराबर रहता है। मतलब जितना द्रव्यमान अभिक्रिया करने के पहले था उतना ही अभिक्रिया के बाद भी रहता है। इसे ही द्रव्यमान संरक्षण का नियम कहते है।

अभिक्रिया से पहले पदार्थों का कुल द्रब्यमान = अभिक्रिया के बाद पदार्थों का कुल द्रब्यमान
अब हम लोग बैज्ञानिक लैंडोल्ट के एक्सपेरिमेंट से समझेंगे तो चलिए शुरू करते है।
बैज्ञानिक लैंडोल्ट का प्रयोग (Landolt’s Experiment) –
बैज्ञानिक लैंडोल्ट ने द्रव्यमान संरक्षण के नियम को सिद्ध करने के लिए एक एक्सपेरिमेंट किया जिसमे उन्होंने काँच की नलियाँ ली जो H आकार में जुड़ी हुई थी। अब उन्होंने दोनों नली में अभिकारक पदार्थों के घोल को भर दिया और सीलबंद कर दिया।
मान लेते है उन्होंने एक नली में पोटेशियम क्लोराइड (KCl) और दूसरी नली में सिल्वर नाइट्रेट (AgNO3) का विलयन लिया उसके बाद उस उपकरण (जुड़ी हुई दोनों नली) को बहुत ही सावधानी से तौला गया। अब उस उपकरण को कई बार उलट – पलट कर अभिकारको में अभिक्रिया करायी गई। अब अभिक्रिया के बाद उस उपकरण को फिर से तौला गया।
आकंड़ो से यह पता चला कि अभिक्रिया होने के बाद भी बने हुए उत्पादों का द्रव्यमान अभिकारको के द्रव्यमान के बराबर था। इस तरह से द्रव्यमान संरक्षण का नियम या द्रव्य की अविनाशिता के नियम सिद्ध हुआ।
रासायनिक अभिक्रिया (Chemical Reaction) –
| AgNO3 + KCl ———– KNO3 + AgCl |
स्थिर अनुपात का नियम उदाहरण देकर स्पष्ट कीजिए? (What is Law of Constant Proportion?)
इस नियम के अनुसार –
सभी रासायनिक यौगिक में चाहे वह किसी भी विधि से बनाया गया हो या उसे प्राप्त किया गया हो। उनके तत्वों के द्रब्यमान एक निश्चित अनुपात में जुड़े होते है या संयुक्त होते है। मतलब एक यौगिक में निश्चित प्रकार के तत्व एक निश्चित द्रव्यमान में संयुक्त रहते है।
इस नियम से यह पता चलता है कि सभी यौगिक का रासायनिक संघटन निश्चित होता है। जो उसके बनाने की मेथड या सोर्स पर निर्भर नहीं करता है।
इस नियम को सबसे पहले फ्रेंच वैज्ञानिक J. L. Proust सर ने सन 1799 ई० दिया था।
चलिए अब हम इसे उदाहरण से समझते है इसमें हम जल से समझेंगे।
Example 1 – देखिये जल (H2O) जो है वह हाइड्रोजन और ऑक्सीजन से मिलकर बना है यानि कि इन दोनों का जल यौगिक है। जल को बहुत से तरीको से बनाया जा सकता है और इसे प्राकृतिक साधनों से प्राप्त भी किया जा सकता है। किसी भी प्रकार से प्राप्त शुद्ध जल का एनालिसिस करने पर ज्ञात होता है कि जल में हाइड्रोजन और ऑक्सीजन, द्रव्यमान की दृष्टि से 1:8 के अनुपात में जुड़े होते है।
Example 2 – देखिये कार्बन डाइऑक्साइड (CO2) कार्बन और ऑक्सीजन से मिलकर बना है। कार्बन डाइऑक्साइड को कई तरीको से प्राप्त किया जा सकता है।
जैसे – कार्बन को हवा में जला करके, सोडियम कार्बोनेट पर तनु हाइड्रोक्लोरिक अम्ल की अभिक्रिया से, कैल्शियम कार्बोनेट को गर्म करके भी कार्बन डाइऑक्साइड को प्राप्त किया जा सकता है। इन तीनो विधियों से प्राप्त CO2 का विश्लेषण करने पर यह पता चलता है कि कार्बन और ऑक्सीजन का द्रव्यमान 12:32 या 3:8 के अनुपात में ही जुड़े रहते है।
गुणित अनुपात का नियम क्या है?
गुणित अनुपात का नियम (Law of Multiple Proportion) –
इस नियम को वैज्ञानिक जॉन डाल्टन ने सन 1803 ई० में दिये थे इस नियम के अनुसार – जब दो तत्व आपस में रासायनिक अभिक्रिया करके एक से अधिक यौगिक बनाते है। तब एक तत्व के समान द्रव्यमान से संयोग करने वाले दूसरे तत्व के द्रव्य्मानो में एक सरल गुणित अनुपात होता है इसे ही गुणित अनुपात का नियम कहा जाता है।
अब हम लोग इसे उदाहरण से समझेंगे तो चलिए समझते है।
NEET या दूसरे बोर्ड Exams के लिए कम्पलीट नोट्स बुक –
NEET Teachers के द्वारा एकदम सरल भाषा में लिखी गई नोट्स बुक 3 in 1, यानि कि एक ही किताब में जीव विज्ञान, रसायन विज्ञान और भौतिक विज्ञान की कम्पलीट कोर्स। यदि आपको इसकी जरूरत है तो नीचे दिए गये बुक इमेज पर क्लिक कीजिये और इसके बारे में और भी जानिए।
गुणित अनुपात का नियम example –
नाइट्रोजन और ऑक्सीजन आपस में जुड़कर के पांच ऑक्साइड बनाते है। इन ऑक्साइडो में नाइट्रोजन और ऑक्सीजन के द्रव्यमानो का अनुपात निम्नलिखित है।
| ऑक्साइड | अणुसूत्र | नाइट्रोजन का ग्राम में द्रव्यमान | ऑक्सीजन का ग्राम में द्रव्यमान | N और O के द्रव्यमान का अनुपात |
| नाइट्रस ऑक्साइड | N2O | 28 | 16 | 14:8 |
| नाइट्रिक ऑक्साइड | NO | 14 | 16 | 14:16 |
| नाइट्रोजन ट्राईऑक्साइड | N2O3 | 28 | 48 | 14:24 |
| नाइट्रोजन टेट्राऑक्साइड | N2O4 | 28 | 64 | 14:32 |
| नाइट्रोजन पेन्टाऑक्साइड | N2O5 | 28 | 80 | 14:40 |
गै-लुसैक का गैसीय आयतन नियम क्या है?
गै-लुसैक का गैसीय आयतन नियम (Gay-Lussac’s Law of Gaseous Volume) –
इस नियम को वैज्ञानिक गै-लुसैक ने सन 1808 ई० दिए थे। इस नियम के अनुसार – जब दो गैसे एकसमान ताप और दाब पर आपस में जुडती है तो उसके अभिकारक के आयतनो में सरल अनुपात होता है और यदि उत्पाद भी गैसे हों तो उनके आयतन भी अभिकारी गैसों के आयतन के सरल अनुपाती होते है।
दूसरे शब्दों में –
जब गैसे परस्पर रासायनिक अभिक्रिया करती है तो उके अभिकारी आयतनो में तथा अभिक्रिया में उत्पाद गैसीय पदार्थो के आयतनो में सरल अनुपात होता है।
Example –
एक आयतन हाइड्रोजन (H2), एक आयतन क्लोरिन (Cl2) के साथ जुड़कर के दो आयतन हाइड्रोजन क्लोराइड (HCl) गैस बनाता है।
यहाँ पर हाइड्रोजन, क्लोरीन और हाइड्रोजन क्लोराइड गैस के आयतन में 1:1:2 का अनुपात है जो कि एक सरल अनुपात है। इस प्रकार से गै-लुसैक के गैसीय आयतन का नियम सिद्ध होता है।
दूसरा उदाहरण –
तीन आयतन हाइड्रोजन (H2), एक आयतन नाइट्रोजन (N2) के साथ अभिक्रिया करके दो आयतन अमोनिया गैस (NH3) बनाता है। अभिकारी गैस हाइड्रोजन, नाइट्रोजन और उत्पाद गैस अमोनिया में परस्पर 3:1:2 का सरल अनुपात है।
दोस्तों आशा करता हूँ कि आपको द्रव्यमान संरक्षण का नियम क्या है? के बारे में दी गई जानकारी पसंद आयी होगी। अगर पसंद आयी है। इसे अपने दोस्तों के साथ भी शेयर कीजिये जिससे उन्हें भी इसका लाभ मिल सके।
धन्यवाद