हेलो दोस्तों क्या आप जॉन डाल्टन का परमाणु सिद्धांत के बारे में अध्ययन करना चाहते हैं वो भी एकदम आसान भाषा में, यदि हाँ तो यह लेख आपके लिए ही है, क्योंकि इस लेख में हम परमाणु सिद्धांत, डाल्टन नियम का परिभाषा, सिद्धांत के दोष, परमाणु द्रव्यमान, औसत परमाणु द्रव्यमान आदि के बारे में अध्ययन करेंगे। तो चलिए बिना समय बर्बाद किये शुरू करते हैं।
जॉन डाल्टन का परमाणु सिद्धांत (John Dalton’s atomic theory in hindi)
सन 1808 में वैज्ञानिक जॉन डाल्टन ने कई एक्सपेरिमेंट के आधार पर एक सिद्धांत दिया।
- द्रव्य अति सूक्ष्म कणों से मिलकर बना होता है जिसे परमाणु (Atom) कहते हैं।
- एक तत्व के सभी परमाणु आकार, आकृति तथा द्रव्यमान आदि गुणों में समान होते हैं जबकि भिन्न-भिन्न तत्वों के परमाणु इन गुणों में भिन्न-भिन्न होते हैं।
- परमाणु को ना तो नष्ट किया जा सकता है और ना ही उत्पन्न किया जा सकता है।
- एक से अधिक तत्वों के परमाणु निश्चित अनुपात में जुड़कर यौगिक/अणु बनाते हैं।
- दो तत्व के परमाणु गुणों में एक दूसरे से भिन्न होते हैं एवं उनके परमाणु भार आकार भी भिन्न-भिन्न होते हैं।
डाल्टन नियम को इस प्रकार परिभाषित किया गया है।
प्रत्येक पदार्थ छोटे-छोटे कणों से मिलकर बना होता है। परमाणु रासायनिक रूप से अविभाज्य है, अर्थात इसे किसी भी रासायनिक और भौतिक विधियो द्वारा विभाजित नहीं किया जा सकता है।
डाल्टन की परमाणु सिद्धांत के दोष –
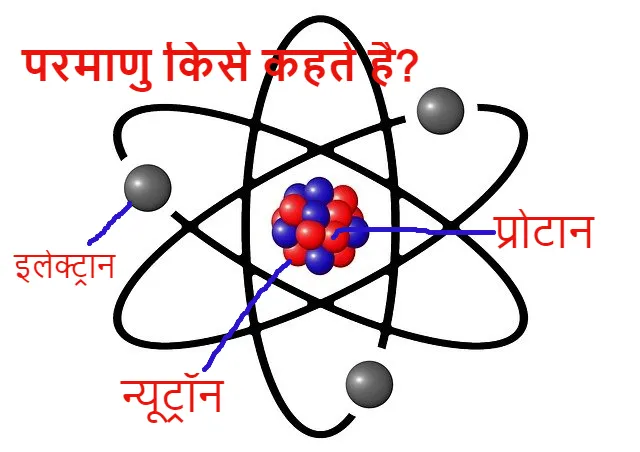
- इस सिद्धांत के अनुसार परमाणु अविभाज्य कण है लेकिन यह तीन कणों (इलेक्ट्रॉन प्रोटॉन न्यूट्रॉन) से मिलकर बना होता है अर्थात् परमाणु को विभाजित किया जा सकता है।
- इस सिद्धांत के अनुसार एक तत्व के परमाणु द्रव्यमान और आकार आदि गुणों में समान होते हैं किंतु समस्थानिकों की उपस्थिति के कारण एक ही तत्व के सभी परमाणु द्रव्यमान और एक आकार भिन्न-भिन्न भी हो सकते हैं। उदाहरण के लिए हाइड्रोजन के समस्थानिक।
- इस सिद्धांत के अनुसार दो तत्वों के परमाणुओं के परमाणु द्रव्यमान भिन्न होते हैं लेकिन संभारिक की खोज के बाद यह निष्कर्ष निकल गया कि भिन्न-भिन्न तत्वों के परमाणु द्रव्यमान सामान भी हो सकते हैं।
- यह सिद्धांत गैलू-सैक के आयतन के नियम की व्याख्या नहीं करता है।

परमाणु द्रव्यमान (Atomic mass) –
एक परमाणु के द्रव्यमान को परमाणु द्रव्यमान कहते हैं इसकी इकाई एकीकृत परमाणु संहति मात्रक (unified atomic mass) संकेत “u” है।
Examples – 12C6, 13C6, 14C6
1H1 or P (Protium), 2H1 or D (Duterium), 3H1 or T (Tritium)
औसत परमाणु द्रव्यमान (Average atomic mass) –
औसत परमाणु द्रव्यमान किसी तत्व के प्राकृतिक रूप से पाए जाने वाले समस्थानिकों के परमाणु द्रव्यमान का भारित औसत होता है।
औसत परमाणु द्रव्यमान = तत्वों के समस्थानिकों का द्रव्यमानों का योग/समस्थानिक की कुल संख्या
12+13+14/3 = 13
आणविक द्रव्यमान (Molecular mass) –
किसी पदार्थ के अणु में सभी परमाणुओं के परमाणु द्रव्यमान का योग आण्विक द्रव्यमान होता है। परिणाम स्वरुप यह एक अणु का सापेक्ष द्रव्यमान है, जो परमाणु द्रव्यमान इकाइयों (u) में दर्शाया गया है।
उदाहरण के लिए
H2O = 2H + O
H2O = 2✕1 + 16 = 18
H2SO4 = 2✕1 + 32 + 4✕16 = 98
CH4 = 12 + 4✕1 = 16